Cohésion de la matière à l'état solide
Interaction électrostatique
La cohésion dela matière à l'état solide provient des interactions électrostatiques entre les particules d'un solide. Le solide peut être ionique (constitué d'ions) ou moléculaire (constitué de molécules).
k est la constante de Coulomb et vaut
Solide ionique
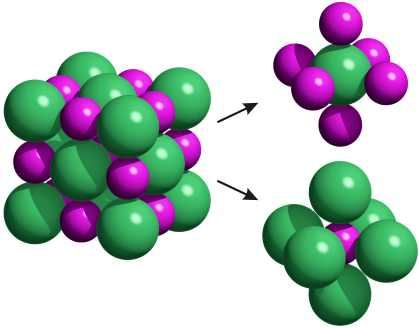
violet : ions Na+, vert : ions Cl-
Un solide ou cristal ionique est constitué d'anions et de cations régulièrement disposés. Chaque ions a pour voisins les plus proches des ions de signe opposé. La solide étant électriquement neutre, sa formule indique la proportion de chaque ion.
Exemples : En gras les anions et les cations constituant les différents solides ioniques.Remarque :La formule d'un solide ionique indique la proportion de chaque ion. Dans le chlorure de fer II il y a un ion Fe2+ pour deux ions Cl-, cela représente donc 1/3 soit 33% d'ions Fe2+.
Molécule polaire
Electronégativité
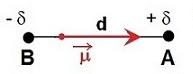
L'électronégativité est une grandeur qui traduit l'aptitude d'un atome à attirer vers lui les électrons d'une liaison covalente.
La liaison entre deux atomes sera polarisée si les deux atomes ont des électronégativités différentes. Plus la différence est impotante plus la liaison est polarisée : on dira qu'elle possède un moment dipolaire noté .
Remarque :
On retiendra, parmi les atomes les plus courant, les atomes du plus au moins électronégatifs : F O N Cl Br I S C H

Polarité d'une molécule
Une molécule est dite polarisée si la somme des moments dipolaires n'est pas nulle (ce qui revient à dire que les barycentres des charges positives et négatives ne sont pas confondus).
Cohésion des solides moléculaires
Dans un solide moléculaire les molécules peuvent être liées par des interactions de type électrostatique.

Interactions de Van der Waals
Si les molécules sont polaires alors elles s'orienteront de façon à présenter le côté négatif de l'une face au côté positif de l'autre. Ces dipôles permanents assurent une forte cohésion des solides.
Même si les molécules sont apolaires, à un moment donné les électrons sont plus près d'un noyau que de l'autre. Il se crée un dipôle instantanné permettant aux molécules de se lier. Cela veut dire qu'à un instant donné les molécules se comportent comme des molécules polaires, mais l'interaction est très faible (le diiode par exemple passera de l'état solide à gazeux en chauffant très légèrement).
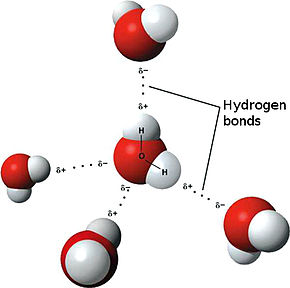
Liaisons hydrogène
Les liaisons hydrogènes sont des liaisons qui s'établissent entre un doublet non liant et un atome d'hydrogène lié à un atome très électronégatif. Moins fortes que les liaisons covalentes, les liaisons hydrogène sont plus fortes que le liaisons de Van der Waals.
Cas des alcanes
Les alcanes sont des hydrocarbures (constitués de C et H) saturés. Les liaisons C-H sont très peu polaires, il faut donc des chaînes carbonées longues pour avoir suffisamment d'interactions de Van der Waals qui assureront la cohésion entre les molécules.
Pour cette raison plus les alcanes sont ramifiés et et à chaîne courte plus leur température de changement d'état est basse.
Miscibilité des alcools dans l'eau
Les alcools sont constitués d'une chaîne carbonée et d'une fonction hydroxyle (-OH). La fonction hydroxyle peut établir des liaisons hydrogène avec les molécules d'eau, ce rend l'alcool miscible avec l'eau. La chaîne carbonée ne le peut pas et est faiblement polaire, elle ne peut donc pas établir de liaisons avec l'eau : on dit qu'elle est hydrophobe. Pour ces raisons plus l'alcool aura une chaîne carbonée longue moins il sera miscible avec l'eau.
Pour cette raison plus les alcanes sont ramifiés et et à chaîne courte plus leur température de changement d'état est basse.
Remarque :Les alcools possédant plus de 7 atomes de carbone ne sont pratiquement plus solubles dans l'eau.