Des atomes aux molécules

Formation de molécules
Règles de "stabilité"
Un atome (ou un ion) est stable si sa dernière couche électronique (couche de valence) est pleine. C'est ce qu'on appelle la règle de l'octet (ou du duet pour l'hydrogène).
C'est le cas des gaz nobles, des ion Cl- ou Na+ par exemple.
Dans les molécules, les atomes "mettront en commun" certains électrons de leur couche de valence afin d'atteindre cette stabilité. Ils forment ainsi des liaisons covalentes liant les deux atomes voisins.
Représentation de LEWIS d'une molécule
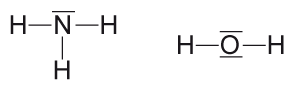
La représentation de LEWIS d'une molécule est constituée de symboles (qui représentent les noyaux et les électrons internes de l'atome) et de tirets qui représentent les doublets d'électrons externes.
Lorsqu'un tiret relie deux symboles il représente une liaison covalente.
Lorsqu'un tiret ne relie pas deux symboles il représente un doublet non liant.
Remarque : les liaisons entre les atomes peuvent être simple, double et même triples.
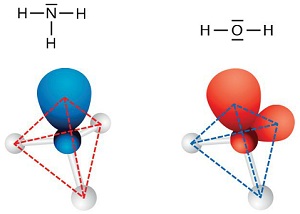
Géométrie des molécules
La structure spatiale d'une molécule est celle qui minimise les tensions (répulsions électroniques.
Pour cela les doublets d'électrons, liants ou non, s'écartent au maximum les uns des autres. Deux doublets se placeront à l'opposé l'un de l'autre (molécule linéaire), trois doublets formeront une molécule triangulaire, quatre doublets donneront une structure tétraédrique.
Isomérie Z et E
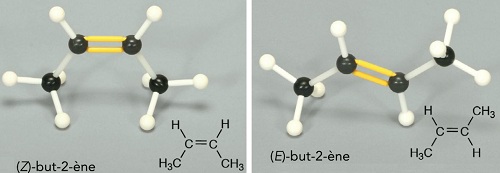
La rotation est possible autour d'une liaison simple, alors qu'elle ne l'est pas autour d'une liaison double. Pour cette raison une molécule portant une doule liaison peut présenter deux isomères :
- L'isomère Z dans lequel les atomes H sont du même côté de la liaison.
- L'isomère E dans lequel les atomes H sont de part et d'autre de la liaison.
Il est possible de passer d'un isomère Z à un isomère E par action de la lumière : c'est la photo-isomérisation.
C'est ce processus photochimique qui est à l'origine de la vision.